作者简介:顾建文,著名脑外科专家,博士导师,解放军第306医院院长,主任医师,全军神经外科副主委,中华医学会理事。
近日一位患者乘坐飞机后一天,发生剧烈眩晕,自感天旋地转,恶心,呈发作性,起病急,自觉周围物体围绕自己旋转(天旋地转)severe dizziness (vertigo),,身体上、下、左、右摇晃,为稳定自己不致摔倒爬行上厕所。检查时眼球呈水平性震颤,面色苍白,她自述水平顺时针旋转,睁眼和闭眼均旋转。头向左侧偏斜症状减轻,头部向下令头部充血时眩晕加重。没有耳鸣ears (tinnitus),耳部炎症。考虑内耳压力增高,内耳眩晕。给与20% 甘露醇注射液250mL地塞米松10mg, 加压静脉滴注,25分钟后症状消失, 眩晕、恶心呕吐、头胀头重、出汗消失。1小时后下床活动,自行回家。看来内耳水肿造成的症状真不小啊!
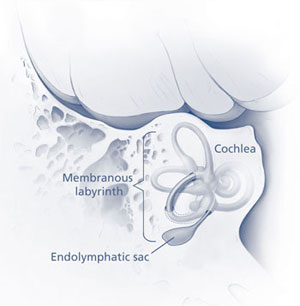
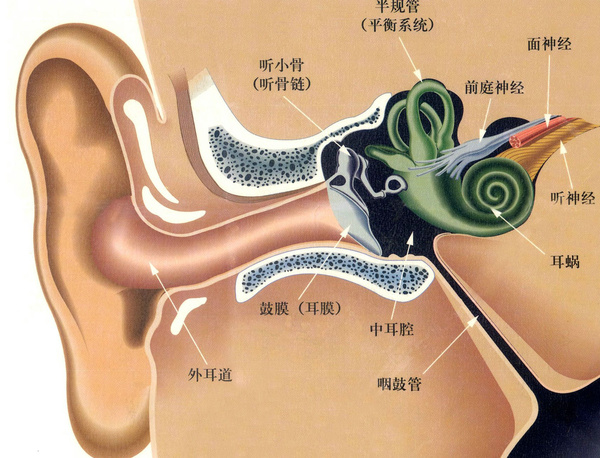
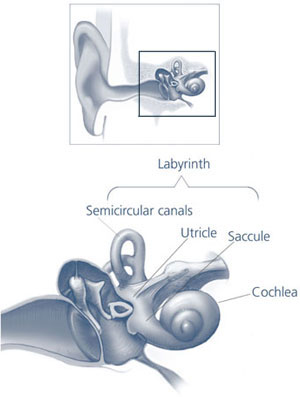
实际上上面这位患者得的是美尼尔氏综合症Meniere’s symptoms是临床上的常见病, 主要是内耳inner ear迷路动脉痉挛, 致使内淋巴液产生过多, 回吸收障碍, 内耳的半规管semicircular canals膜迷路endolymphatic sac发生积水引起膜迷路水肿和内淋巴系压力增高所致。因甘露醇在体内不被代谢, 其高渗溶液经静注进入血管, 到达脑部, 不易从毛细血管透入组织, 故能迅速提高血浆渗透压, 使组织间液向血循环转移,致组织脱水而从肾脏排出, 因此能使膜迷路水肿减轻以致消除, 内淋巴系压力降低, 以致改善膜迷路血管的痉挛, 改善前庭和内耳的微循环, 改善局部缺氧状况, 从而迅速消除眩晕症状;
1861年Meniere医生首次对眩晕病人的平衡器官作了解剖,发现平衡器官有异常病理改变,压力增大,循环障碍,保持不了液体平面,从而揭开了眩晕的由来。从此这种眩晕症被称为美尼尔氏综合症。美尼尔氏综合症常见于中年人,临床上主要表现为眩晕、耳鸣、耳聋、头内胀痛,以及出现眼球震颤、平衡失调、恶心、呕吐、心律变慢、血压下降、面色苍白等植物神经症状。其眩晕呈突发性旋转时,感觉自身或周围的物体旋转,但神志清楚。发作数小时或数天后逐渐的恢复,数周或数年发作一次。耳鸣多为低频音,眩晕前就可出现,眩晕发作时加重。耳聋早期不常感觉,发作数次后才感觉到耳聋。
美尼尔氏综合症可分为八种类型。
1、普通型,眩晕、耳鸣、恶心、呕吐、出汗等症状同时出现,又称常见型。2、首发耳鸣型,耳鸣发生在其他症状之前,数月、数周数年。3、重耳鸣型:耳鸣表现重。耳鸣发生了,眩晕易发作,眩晕表现重,耳鸣也重。眩晕治疗好了,耳鸣未好,眩晕必复发。4、无耳鸣型,眩晕发作5次以上无耳鸣,称无耳鸣型。5、突发耳聋型,眩晕发作过程中,由于压力特大,膜述路破裂,发生突然耳聋。耳聋多—侧,亦有双侧交替发生。耳聋早期治疗效果理想。6、延缓眩晕型,波动性、神经性、进行性耳鸣、听力下降,(短时间不发生眩晕)复数年甚至20年才出现眩晕。7、隐藏耳鸣型,病人外表表现没有耳鸣,但耳内有堵塞、闷胀、闷热、瘙痒、微痛的感觉,这是一种隐藏无耳鸣型美尼尔氏综合症。8、眩晕状态型,一个月内发作三次以上,患者处于眩晕状态,称眩晕状态型,又称重型。
美尼尔氏综合症检查
1、耳镜检查鼓膜正常。声导抗测试鼓室导抗图正常。咽鼓管功能良好。2、颞骨X线片无异常。断层片下偶显前庭水管周围气化差,水管短而直。3、前庭功能检查:发作期可观察到或用眼震电图描记到节律整齐,强度不同,初向患侧继而转向健侧的水平或旋转水平性自发性眼震和位置性眼震。动静平衡功能检查结果异常。间歇期各种自发和诱发试验结果可能正常。多次复发者可能减退或丧失、冷热试验有优势偏向。镫骨足板与膨大的球囊粘连时,增减外耳道气压,有时可诱发眩晕与眼震,称安纳贝尔(Hennebert)征。4、听力检查:呈感音性聋。音叉测验:Weber试验偏向健侧,Rinne试验阳性,Schwabach试验骨导缩短。纯音测听:患耳气骨导阈值均升高,听力图早期为上升型或平坦型,晚期可呈下降型,重复测试听阈明显波动。阈上功能检查,双耳交替响度试验,短增量敏感指数试验证明有重振现象;音衰试验正常;自描测听曲线多为Ⅱ型。镫骨肌声反射阈与纯音听阈差缩小。耳蜗电图的SP-AP复合波增宽;SP-AP异常增加;AP的振幅-声强函数曲线异常陡峭。5、甘油试验:按1.2~1.5g/kg的甘油加等量生理盐水空腹饮下,服用前与服用后每隔1小时做1次电测听,共做3次。若患耳听力在服甘油后提高15分贝或以上者为阳性。本病患者多为阳性,但在间歇期,脱水等药物治疗期为阴性,若对听力损害轻微与重笃无波动开测试结果也有可能为阴性。眼用甘油后耳蜗电图中SP值绎低,耳声发射由无到有,均可做为阳性结果的客观依据。尿素、乙酰唑胺曾被用做类似试验。
药物治疗能够暂时降低平衡器官中的迷路淋巴循环的压力 1)保持安静,静卧。2)对症治疗,使用镇静药:如安定,谷维素;配合非那根。3)酌情选用血管扩张药:西比林,氢溴酸山莨菪碱(654-2)AnisodamineHydrobromide。4)应用利尿药:双氢克尿噻,氨本蹀定。5)局部药物封闭:10%普鲁卡因10ML作星状神经封闭。
外科治疗适用于药物治疗无效,病人又丧失工作能力的。局限于单侧有病的患者。手术概括为:破坏性、半破坏性、保守性3种类型。内淋巴囊减压术,球囊造瘘术、迷路破坏术,前庭神经切断术。保守手术有多种,有内淋巴囊切开术、球囊减压术、交感神经切断术、鼓索神经切断术、内淋巴蛛网膜下腔分流、镫骨底板开窗术和内淋巴囊乳突腔分流等。综合分析,多是开窗减压术。手术治疗不理想,短时间开窗减压术有一定的作用。
中药治疗白姜散:白果仁60克,干姜12克。用法:上药烘干共研末,分成8份,每份9克每天早晚饭后以红枣12克,黄芪20克煎水各服1份。从辨证的角度分析,凡是眩晕症的病人,治疗的方法多数是以辨证论治。眩晕的发生与人的脏腑有关,肾阴不足水不涵木;脾阳不振运化失司;肝阳上亢诸风掉眩;清浊升降失调,聚湿痰积必眩晕。要根据药性选药。
产生内耳膜迷路积水的根本原因及机制
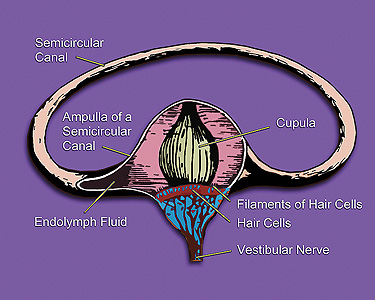
1 . 内淋巴囊与内淋巴管的机械阻塞:1927 年Guild 首次提出, 内淋巴纵流是膜迷路容量调节的经典理论之一, 1964 年Lundquist 等用同样的方法证实了这种内淋巴纵流学说: 即耳蜗内淋巴液由蜗管外壁的血管纹分泌产生, 经联合管汇入球囊, 再经内淋巴管向内淋巴囊流动, 最终在内淋巴囊被吸收, 由此维持其容量、成份的稳定。内淋巴囊是膜迷路的一部分, Lundquist( 1964 年) 将其分为近侧段、远侧段和中间段三部分。近侧段位于骨龛内; 中间段部分位于骨龛内, 部分位于硬脑膜两层之间; 远侧段位于侧窦上的硬脑膜内; 其上皮细胞可分为亮细胞、暗细胞和中间细胞三型, 而其主要功能为吸收、分泌内淋巴液并调节膜迷路的压力 。内淋巴管连接内淋巴囊与球囊, 主要部分在前庭导水管内, Qv or trup 等的研究认为内淋巴管存在跨上皮屏障的水和离子的转运, 与内淋巴液的吸收密切相关。根据其解剖及组织学特点推断, 任何原因造成的内淋巴囊或内淋巴管的机械狭窄或梗阻, 都会引起内淋巴液的吸收障碍, 从而产生膜迷路积水。
2 . 水通道蛋白( aquapo rinl, AQP) 的活性增加1988 年Denker 等[ 4] 在对红细胞膜进行分离纯化Rh 多肽时发现一个分子质量为28 000 的疏水性跨膜蛋白, 同时发现其与晶状体内在蛋白MIP26 氨基酸序列相近, 随后开展的研究证实其具有转运水的功能, 1997 年由基因组命名委员会正式命名为水通道蛋白1 ( aquapor inl, AQP1) 。迄今为止已发现11 种水通道蛋白亚型, 分别命名为AQP0~ 10。现有的研究结果表明, 内耳也存在除AQP0、AQP8 及
AQP10 以外的各型AQP 家族成员。它们对液体的跨膜转运、维持内耳的液体平衡起重要作用。很多研究者应用原位杂交、RT - PCR、免疫组化等方法对AQPs 各个亚型在内耳的分布情况进行了研究。研究对象主要是大鼠、小鼠和豚鼠。研究显示, AQPs 各亚型分子广泛分布于内耳耳蜗、前庭、内淋巴囊和内淋巴管等各个区域, 其中以AQP1 的分布最广, 但各物种、各亚型间的分布模式有差异, 提示不同区域的水分子代谢是由不同的AQP 分子来完成的 。AQP2 水传输的生理作用和其在耳蜗内的表达方式说明, AQP2 在内耳液体稳态起着重要作用。在各亚型中关于AQP2 与内淋巴积水的研究较多, AQP2 是血管加压素( AVP) 对集合管水通透性进行调节的主要对象, 其调节途径为血管加压素( AVP) - 血管加压素受体2( V2R) - 环磷碱腺苷( cAMP) - 水通道蛋白2( AQP2) 水转运途径。血管加压素( AVP) 也称抗利尿激素或垂体加压素, 是机体重要的水代谢调节激素。Beitz 等 通过实验观察结果, 提出血管加压素对于内淋巴液体调节的可能机制, 包括: . 内淋巴液相对于外淋巴液及血清为高渗( 305mOsm/ kg 比285mOsm/ kg) ; 水可以通过水通道由低渗向高渗转运, 使得内淋巴的水增多。# AQP2 在内淋巴囊表达, 推测在内淋巴囊存在AVP- V2R- cAMP - AQP2 水转运途径; 在内淋巴囊的基底侧部分血管加压素的刺激将引起顶端膜AQP2 水通道蛋白数量的增加, 进而通过环磷酸腺苷( cAMP) 介导的磷酸化作用使AQP2 立体结构发生改变, 导致通道开放, 引起水流部分的向内淋巴快速流动, 引起内淋巴水的增多。. 内淋巴囊的基底部分表现出一种高度活跃的内吞作用, 这种作用可被血管加压素抑制, 导致内淋巴吸收功能的障碍, 而引起内淋巴水的储留[10] 。由此推测, 在生理情况下血管加压素可能是在循环血量减少时通过上述机制减少内淋巴的吸收, 增加水的内流, 从而稳定内淋巴的容量。但当血管加压素水平呈病理性升高, 并且持续一段时间时, 则将导致内淋巴积水的发生。
3 . 免疫复合物的沉积随着耳免疫学研究的进展和深入, 大量实验研究和临床观察结果发现, 部分膜迷路积水的发生与自身免疫有关, 但其免疫病理机制还不清楚。其中循环免疫复合物介导的% 型变态反应在膜迷路积水中起的作用得到了实验及临床方面的支持。目前关于免疫复合物在内耳中的沉积部位及其免疫病理作用, 大致有以下几种看法: 其一: 免疫复合物沉积于血管纹, 沉积可能使得血管纹的血管通透性增高, 从而引起内淋巴液的分泌机能发生障碍, 内淋巴分泌增多, 最终导致膜迷路积水的发生。其二: 免疫复合物沉积于内淋巴囊, 免疫复合物的沉积引起血管损伤将导致局部缺血, 上皮损伤以及上皮下区域的纤维逐渐变性, 这些对内淋巴囊的损伤将妨碍淋巴液的运输, 最终导致膜迷路积水。第三: 免疫复合物既沉积于血管纹又沉积于内淋巴囊, 其二者共同的作用导致膜迷路积水。
4 . Na+ ..K+ ..AT P 酶活性增高Jo hnstone 等( 1981 年) 以膜迷路系统晶体渗透压升高学说解释膜迷路积水, 即考虑由于各种因素造成的内淋巴液中各种电解质浓度变化, 而引起膜迷路系统晶体渗透压升高而产生膜迷路积水。1996 年Yao[13] 用免疫组化的方法在大鼠耳蜗组织的内外毛细胞、血管纹、螺旋韧带、螺旋神经节细胞中盐皮质激素的受体的高表达。盐皮质激素( 醛固酮) 通过直接或间接的作用于Na+ .K+ .ATP 酶, 而导致Na+ .K+. AT P 酶活性增高, 分泌入内淋巴的K+ 增加, 内淋巴晶体渗透压升高, 进入内淋巴的水增多, 最终导致内淋巴积水。
5 . 内淋巴钙( Ca2+ ) 浓度的升高内淋巴是人体液中唯一与细胞内液离子浓度相似的体
液, 正常情况下, 通过血管纹及前庭膜上的Ca2+ ..ATP 酶介导, Ca2+ 从外淋巴主动运转到内淋巴[ 18] 。生理条件下内、外淋巴液中Ca2+ 的浓度分别为10- 5M 和10- 3M, 内淋巴中低浓度Ca2+ 的维持有赖于内淋巴较高的蜗内电位( endoco.chlear po tent ial, EP) , 以及血管纹及前庭膜上Ca2+ ..ATP 酶的重要调节作用。推测各种原因所造成的膜迷路积水可能引起内淋巴的Ca2 + 浓度的增高, 而内淋巴内高浓度的Ca2 + 又进一步加重了积水。
6 . 一氧化氮及一氧化氮合酶的作用在一种还原型烟酰胺腺嘌呤二核苷酸( NADPH ) 依赖酶( NO 合成酶, 即NOS) 的各种亚型存在的条件下由许多种类的细胞产生的单一无机物, 作为第二信使参与神经传导, 调节血管通透性、平滑肌张力及免疫反应。耳蜗内的NO 与耳蜗血流调节、内淋巴液离子稳定性和神经传导等生理过程有关, 还影响内耳多种疾病的生理病理过程。一方面, 很多研究认为NO 作为一种最不典型的神经递质, 主要是通过N- 甲基- 右旋天门冬氨酸( NMDA) 受体起神经递质作用。兴奋性谷氨酸( Glu) 通过激活NM. DA 受体引起膜的去极化Ca2+ 内流, 激活NOS 生成NO, 大量的NO 生成引起细胞内Ca2+ 超载, 从而发挥毒性作用。另一方面, 由于NO 不带电荷, 含有一个未配对电子, 大量生成时可与O2 生成过氧硝基阴离子, 分解成OH- 和NO2- , 从而作为自由基产生毒性作用[ 25] 。此外, 已有证据表明NO 可通过NO/ 蛋白激酶C( cGMP) 通路调节细胞内钙离子的浓度, NO 能通过增加细胞内cGM P 抑制钙依赖性钾离子流 。所以, NO 可能通过这些途径或其他途径影响钙离子
通道或钾离子通道从而发挥对耳蜗功能的调节作用, 这种可能还需要进一步的证实。
将NOS 分为三类[27] : 诱导型NOS( iNOS) 和结构型NOS ( cNOS) , cNOS 又包括内皮型NOS( eNOS) 和神经元型NOS( nNOS) 。诱导型NOS( iNOS) : 诱导型NOS( iNOS) 的基因在生理情况下一般不表达, 但在大肠杆菌内毒素( LPS) 或肿瘤坏死因子.( TNF..) 的刺激下, 耳蜗的旋韧带血管壁、蜗轴、螺旋器的支持细胞、螺旋缘、神经纤维及部分螺旋神经节的核周体开始表达iNOS, 内淋巴囊[29] 的上皮细胞及内淋巴腔内的巨噬细胞也有iNOS 的表达。iNOS 的表达能持续催化产生大量的NO[30] , 而高浓度的一氧化氮及其相关自由基有细胞神经毒性。主要位于内皮细胞的细胞膜。耳蜗和前庭神经细胞、神经纤维、内毛细胞和外毛细
胞的胞浆、螺旋缘的被覆细胞、耳蜗小球的内皮细胞均有eNOS 的分布。内皮细胞中的NO 可以调节和控制内淋巴囊的血流, 从而影响到内淋巴液压力的调节。
膜迷路积水的发生是多种作用机制共同作用的结果,发展可能都不仅仅是单一因素造成的。上述这些被认为是产生膜迷路积水的可能机制, 它们之间相辅相成的作用加快了膜迷路积水的进程。