作者简介:顾建文,著名脑外科专家,解放军总装备部总医院(解放军第306医院)院长;全军高层次科技领军人才、博士导师、中华医学会理事,解放军神经外科专委会副主任委员;擅长脑肿瘤微创手术、脑血管疾病、癫痫、帕金森、脊柱疾病。获得2008全军科技进步一等奖、2013年四川省科技进步一等奖及十余项省部级奖励。完成手术6000余台。
精神分裂症是一种慢性、复杂的精神心理障碍,多发病于青壮年并持续终生,全球约有1%的人患有精神分裂症。大量研究表明,中枢神经系统功能异常可能与精神分裂症有关,并提出若干种假说,如多巴胺(DA)系统功能失调假说、5-羟色胺系统和多巴胺系统平衡失调假说、NMDA受体功能低下假说等。多巴胺系统功能失调假说认为脑内存在两条与精神分裂症相关通路,当多巴胺功能亢进时,经中脑边缘通路造成精神分裂阳性症状(如幻觉、妄想、思维紊乱等),多巴胺功能低下则通过中脑皮质-额叶皮层通路产生阴性症状(如回避社交、情感淡漠、思维贫乏、快感缺失等)和认知功能障碍(如注意力、工作记忆、执行功能破坏等)。目前,精神分裂症病理机制尚未明确,对精神分裂症的治疗以终身服药控制症状和防止复发为主。临床使用的药物主要分为典型和非典型抗精神病药,典型抗精神病药,也称为第一代抗精神病药,例如Chlorpromazine、Haloperidol等,主要通过阻断多巴胺D2受体(D2R)起效,其对精神分裂症的阳性症状有显著疗效,但较少针对阴性症状调节和认知功能改善,当对D2R阻断比率过高时(超过80% )往往造成纹状体内DA功能下调,从而导致锥体外系副反应( EPS)的发生及负性症状的恶化;非典型抗精神病药(第二代,Clozapine, Olanzapine, Risperidone)结合多个受体,除主要阻断D2R外,部分作用于5-HT2A、a1-肾上腺素受体 (ARs)、组胺受体以及毒蕈碱等神经递质,其对精神分裂症的阳性症状及阴性症状均有一定疗效,且减少了EPS副反应发生,但其多靶点作用往往造成其他不良反应,如粒细胞缺乏症、体重增加、QT间隙期延长、性功能障碍等。由此可见,以D2R拮抗剂为主要特征的第一代、第二代抗精神分裂药物在临床应用中仍然存在一定缺陷,迫切需要开展新型抗精神分裂药物研发,重点针对患者认知功能的改善和对精神分裂阴性症状的调节,以及减少EPS等副反应的发生。
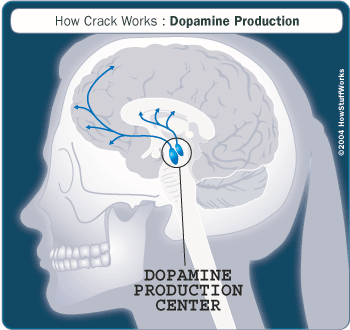
脑内多巴胺通路
1990年,Sokoloff等成功克隆出多巴胺D3受体(D3R),将DA受体明确分为五种亚型,包括D1型(D1R、D5R)和D2型(D2R、D3R、D4R)。D3R主要分布在中脑边缘区的伏隔核和Calleja岛,大量研究表明D3R与情绪、认知、精神、运动控制等关系密切。对精神分裂症患者的尸检研究表明,患者中脑边缘区和纹状体D3R密度升高程度显著,而给予抗精神分裂药物治疗的患者,其D3R表达相对正常;D3R基因第一外显子Ser9gly的多态性与精神分裂症发病率密切关联;D3R基因敲除小鼠在精神分裂症动物模型中的研究表明,区别于D2R阻断,D3R拮抗剂可有效避免运动障碍等EPS副反应的发生;选择性阻断D3R受体而较少作用于D2R受体,有助于改善认知功能。根据以上研究结果,多巴胺D3受体迅速成为抗精神分裂症新药研究的潜在靶点,国内外学术界普遍认为药物选择性作用于D3R,不仅有利于患者认知功能改善,且其疗效尤其是避免不良反应方面将较之D2R靶点药物更具优势。上述假设不断推动D3R与精神分裂症相关病理机制的研究和D3R靶点药物研发。研究表明,D3R激动剂(+)-PD128,907能抑制NMDA受体拮抗剂引发的动作刻板症,显示D3R激动剂能部分改善精神分裂症状。S33084、SB-277011-A、AVE5997等高选择性D3R拮抗剂能在实验剂量内不产生D2R阻断作用,但应用于经典精神分裂症模型后,并未表现出显著抗精神分裂作用,高选择性D3R拮抗剂应用于精神分裂症治疗的可行性尚需进一步实验验证。
近年来,在抗精神分裂症新药研发中,部分研究以D2R靶点确切的抗精神分裂作用为基础,突出D3R靶点在改善患者认知功能、有效避免EPS副反应等方面的潜在优势,开展了D2R、D3R联合靶点药物的研究。例如,优先结合D3R的D3R/D2R拮抗剂S33138(D3R/D2R选择性约为25倍)能有效抑制阿扑吗啡诱发的小鼠攀爬行为,以及安非他明、可卡因等诱发的大鼠高活动性,条件性回避反应等,表现出良好的抗精神分裂作用,更为重要的是,其对东莨菪碱诱发的大鼠认知功能下降有显著的改善,此外,在最大剂量范围内未见发生强直性木僵行为。目前,D3R/D2R拮抗剂S33138、RG-15和A-437203由于良好的抗精神分裂作用以及在避免EPS不良反应、改善认知功能方面的优势,均已进入临床Ⅱ期研究。除了D2R、D3R联合靶点药物,DA部分激动剂的独特功能调节作用也广泛应用于抗精神分裂新药研究。与拮抗剂不同,DA部分激动剂具有一定的内在活性,依赖于内源性DA水平表现出激动/拮抗双相调节作用。在精神分裂研究中,有望通过拮抗/激动双重作用分别调节中脑边缘DA活性过度和中脑皮质DA功能缺失,从而有效控制精神分裂症阳性和阴性症状。此外,部分激动剂区别于拮抗剂对DA受体的完全阻断作用,更好的避免了对纹状体D2R过度阻断造成的EPS、泌乳素升高等副反应。研究表明,(-)-3PPP、Terguride、SDZ-208912、Bifeprunox、Aripiprazole等D2R部分激动剂在抗精神分裂临床研究中均表现出显著的双相调节作用,且较好的避免了EPS副反应的发生。其中,(-)-3PPP、Terguride、SDZ-208912的内在活性偏高(大于40%),导致其抗精神分裂作用持续时间较短,限制了进一步的临床研究。Bifeprunox进入Ⅲ期临床研究,但缺少长效维持治疗的相关数据及代谢资料,尚未获得FDA核准。Aripiprazole具备适度的内在活性(约30%),成为第一个应用于抗精神分裂治疗的D2R部分激动剂,于2002年通过美国FDA审核,作为治疗精神分裂症一线用药,并于2004年补充申请为急性双相精神障碍治疗药物。
Cariprazine (RGH-188)是首个报道应用于抗精神分裂研究的D3R/D2R部分激动剂,兼具优先结合D3R和DA部分激动剂的特点,其D3R/D2R选择性约为10倍。研究发现:Cariprazine能有效抑制阿扑吗啡诱导的小鼠攀爬行为,安非他明诱导的大鼠高活动性和条件性回避反应等,抑制NMDA非竞争性拮抗剂MK-801模型小鼠的运动刺激效应等,表现出良好的抗精神分裂作用;此外,超过ED50剂量100倍,仍未见小鼠发生强直性木僵行为;在水迷宫实验中,显著提高东莨菪碱记忆损伤大鼠的学习认知功能;Ⅱ期临床研究表明Cariprazine具有潜在的双相抗躁郁症作用。针对临床常用抗精神分裂药物的缺陷,D3R/D2R部分激动剂在综合改善患者认知功能、调节精神分裂阴性症状,以及减少EPS副反应等方面的良好前景为开展新型抗精神分裂药物研发提供了一条全新的研究思路。目前, Cariprazine是唯一应用于抗精神分裂研究的D3R/D2R部分激动剂,由于在不同种类评价体系中,Cariprazine对D2R、D3R表现出不一致的拮抗、部分激动活性,例如,[35S] GTPγS结合试验表明其为D2R、D3R纯拮抗剂,而IP聚集、cAMP抑制实验表明其为D3R、D2R部分激动剂。因此,以Cariprazine为药理探针,对D3R/D2R部分激动剂的抗精神分裂作用进行深入评价和相关机理研究受到一定影响,特别是Cariprazine部分激动效应对精神分裂阴性症状的调节作用并未进行深入研究。文献报道的其它D3R/D2R部分激动剂,例如BP897、FAUC329等,则因D3R/D2R选择性过高(超过100倍),在抗精神分裂症研究中效果不显著,主要应用于帕金森氏症和药物成瘾研究。课题申请者认为有必要自行设计、合成,并筛选得到1-2个D3R/D2R选择性适当(10-100)、内在活性数据确切的新型D3R/D2R部分激动剂,建立更为全面的精神分裂症动物行为学模型进一步评价其抗精神分裂疗效,为更好的指导新型抗精神分裂症药物研发、开发具有自主知识产权的新型候选药物奠定基础。